Болевая сенсорная система
(болевой анализатор)
Болевая сенсорная система - это совокупность нервных структур, воспринимающих повреждающие раздражения и формирующих болевые ощущения, т. е. боль. Понятие «болевая сенсорная система» явно шире, чем понятие «болевой анализатор», т. к. в состав болевой сенсорной системы обязательно включается система противодействия боли - «антиноцицептивная система». Понятие «болевой анализатор» может обойтись без антиноцицептивной системы, но это будет существенным упрощением.
Важная особенность болевого анализатора состоит в том, что адекватные (подходящие) для него раздражители могут относиться к самым разным классам. В качестве раздражения выступает повреждающее действие, следовательно, раздражители для болевого анализатора – это повреждающие факторы.
Что повреждается и нарушается:
Целостность покровов тела и органов.
Целостность клеточных мембран и клеток.
Целостность самих ноцицептивных нервных окончаний.
Оптимальное течение окислительных процессов в тканях.
В целом повреждения являются сигналом о нарушении нормальной жизнедеятельности.
Определение понятия «боль»
Существует два подхода к пониманию боли:
1. Боль – это ощущение . Оно имеет сигнальное значение для организма, точно так же как и ощущения другой модальности (зрение, слух и т.д.).
Боль – это неприятное, приносящее страдание ощущение , возникающее под действием сверхсильных раздражителей, в результате повреждения тканей или при кислородном голодании.
Боль – это психофизическое состояние дискомфорта.
Оно сопровождается изменением деятельности органов и систем, возникновением новых эмоций и мотиваций. При этом подходе боль рассматривается как следствие той первичной боли, которую подразумевает первый подход. Возможно, более точным было бы в этом случае выражение «болезненное состояние» .
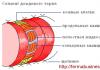
1-й отдел болевого анализатора (п ериферический)
Периферический отдел любого анализатора занимается рецепцией и трансдукцией , т.е. первичным восприятием адекватного для него раздражения.
Рецепторы боли называются ноцицепторами . Это высокопороговые рецепторы, реагирующие на разрушающее, повреждающее или нарушающее какой-либо процесс воздействие.
Виды ноцицепторов:
- Механоноцицепторы расположены преимущественно в коже, фасциях, сухожилиях, суставных сумках и слизистых оболочках пищеварительного тракта. Это свободные нервные окончания миелинизированных волокон типа А-дельта со скоростью проведения возбуждения 4-30 м/с. Они реагируют на деформацию и повреждение мембраны рецептора при сжатии или растяжении тканей. Для большинства этих рецепторов характерна быстрая адаптация.
- Хемоноцицепторы расположены также на коже и в слизистых оболочках, но преобладают во внутренних органах, где локализуются в стенках мелких артерий. Они представлены свободными нервными окончаниями немиелинизированных волокон типа С с низкой скоростью проведения возбуждения 0,4-2 м/с. Специфическими раздражителями для этих рецепторов являются химические вещества (алгогены - «рождающие боль»), но только те, которые отнимают кислород у тканей, нарушают процессы окисления.
Типы алгогенов:
1. Тканевые алгогены (серотонин, гистамин, ацетилхолин и др. биологически активные вещества). Они, как правило, выделяются при разрушении тучных клеток соединительной ткани и, попадая в межклеточную жидкость, непосредственно активируют хемоноцицепторы .
2. Плазменные алгогены (брадикинин, каллидин и простагландины) повышают чувствительность ноцицепторов к другим алгогенам.
3. Тахикинины выделяются из нервных окончаний. Так, к ним относится вещество «П» (на латыни - «P»), которое является полипептидом. Они воздействуют местно на мембранные рецепторы того же самого нервного окончания.
Существование ноцицепторов подтверждает теорию специфичности боли, что боль это специфическое ощущение, и для него есть свои рецепторы, нервные пути и собственная сенсорная система боли.
Но существует и неспецифическая теория боли. Согласно ей, при очень сильных повреждающих воздействиях рецепторы различных модальностей могут порождать ощущение боли. В настоящее время приняты обе теории.
Сенсорная болевая единица – это рецепторный аппарат и связанная с ним периферическая часть афферентного волокна. Само окончание реагирует на ноцицептивное воздействие, ближайший участок волокна возбуждается при возбуждении окончания. Получается, что болевой нерв имеет два участка , где рождается болевое ощущение, точнее, «болевое возбуждение» .
2-й отдел б олевого анализатора (проводниковый)
Проводниковый отдел любого анализатора занимается проведением нервного возбуждения, рождённого в периферическом отделе (первом).
В отличие от представлений И.П. Павлова в современной физиологии сенсорных систем большое значение придаётся работе с сенсорным возбуждением низших нервных центров (подкорковых).
Схематично проведение болевого возбуждения можно изобразить так: (1) рецептор-ноцицептор - (2) нервный ганглий (нервный узел) - (3) спинной мозг (задние рога) - (4) ретикулярная формация , либо средний мозг, либо таламус - (5) таламус - (6) кора больших полушарий головного мозга.
Болевое возбуждение от рецепторов (ноцицепторов) в виде нервного импульса перемещается по дендритам первого афферентного нейрона к чувствительным ганглиям, которые иннервируют определенные участки организма. Из нервных ганглиев по аксонам тех же самых первых нейронов возбуждение поступает в спинной мозг к вставочным нейронам заднего рога – это второй афферентный нейрон.
От него возбуждение может пойти двумя путями.
Болевые нервные пути:
Специфический (лемнисковый). Аксоны вставочных нейронов спинного мозга (вторые болевые нейроны) в составе спиноталамического тракта идут к специфическим ядрам таламуса . В таламусе возбуждение поступает в вентробазальное ядро и передается на третий нейрон. Аксон третьего нейрона достигает коры головного мозга. Особенность специфических ядер таламуса состоит в том, что они передают возбуждение «прямо по назначению» в нужную зону коры.
Неспецифический (экстролемнисковый). Начинается от вставочного нейрона спинного мозга (второго болевого) и по коллатералям идет в различные структуры мозга. В зависимости от места окончания выделяют три основных тракта - неоспиноталамический (спинной мозг - таламус), спиноретикулярный (спинной мозг - ретикулярная формация), спиномезенцефалический (спинной мозг - средний мозг). Возбуждение по этим путям поступает в неспецифические ядра таламуса и оттуда во все отделы коры больших полушарий. Особенность неспецифических ядер таламуса как раз и заключается в том, что они обеспечивают обширные связи таламуса с разными структурами головного мозга.
3-й отдел б олевого анализатора (к орковый или центральный)
Специфический путь болевого возбуждения заканчивается в соматосенсорной области коры больших полушарий головного мозга. Болевое возбуждение приходит туда из специфических ядер таламуса.
Выделяют две соматосенсорные зоны коры:
1. С 1 – первичная проекционная зона . Она формирует ощущение острой, точно локализованной боли. За счет тесных связей с моторной зоной коры отсюда запускаются моторные акты при возбуждающем болевом воздействии.
2. С 2 – вторичная проекционная зона . Она обеспечивает процессы осознания боли и выработки программы поведения при болевом воздействии.
Неспецифический путь болевого возбуждения распространяется на все области коры . Большое значение имеет орбито-фронтальная область коры (лежащая сразу же позади глазниц), которая участвует в организации эмоционального и вегетативного компонентов боли.
Важно отметить, что в реакцию организма на боль вовлекаются практически все структуры головного мозга . По коллатералям болевого анализатора возбуждение передается параллельно на ретикулярную формацию, лимбическую систему, гипоталамус и двигательные ядра.
Компоненты болевой реакции
1. Двигательный компонент.
Возбуждение от моторной зоны коры доходит до мотонейронов спинного мозга, они передают его на мышцы, которые осуществляют двигательные реакции. В ответ на боль возникают двигательные рефлексы, рефлексы вздрагивания и настороженности, защитные рефлексы и поведение, направленное на устранение действия вредоносного фактора.
2. Вегетативный компонент.
Он обусловлен включением в системную болевую реакцию гипоталамуса - высшего вегетативного центра. Этот компонент проявляется в изменении вегетативных функций, необходимых для обеспечения защитной реакции организма. Меняется величина артериального давления, частота сердечных сокращений, дыхания, происходит перестройки обмена веществ и т.д.
3. Эмоциональный компонент.
Он проявляется в формировании отрицательной эмоциональной реакции, что обусловлено включением в процесс возбуждения эмоциогенных зон мозга. Эта отрицательная эмоция, в свою очередь, провоцирует различные поведенческие реакции: бегство, нападение, затаивание.
Каждый компонент болевой реакции может быть использован для оценки специфичности болевого ощущения.
Виды боли
В зависимости от путей проведения болевого возбуждения:
1. Первичная боль - эпикритическая . Эта боль чётко локализована , имеет обычно резкий, колющий характер, возникает при активации механорецепторов, возбуждение движется по А-волокнам, по неоспиноталамическому тракту в проекционные зоны соматосенсорной коры.
2. Вторичная боль – протопатическая. Эта боль медленно возникает, имеет нечёткую локализация, для неё характерен ноющий характер. Возникает при активации хемоноцицепторов, возбуждение движется по С-волокнам, палеоспиноталамическому тракту в неспецифические ядра таламуса, оттуда распространяются по различным областям коры. Этот вид боли обычно сопровождается моторными, вегетативными и эмоциональными реакциями.
В зависимости от ноцицепторов:
1. Соматическая , возникает в коже, мышцах, суставах и т.д. Она двухфазная: вначале эпикритическая затем протопатическая. Интенсивность зависит от степени и площади повреждения.
2. Висцеральная, возникает во внутренних органах, ее трудно локализовать. Боль может проецироваться на совсем другие участки, не те, где находятся породившие ее ноцицепторы.
В зависимости от локализации боли:
1. Местная боль, локализуется непосредственно в очаге ноцицептивного воздействия.
2. Проекционная боль, ощущение распространяется по ходу нерва и передается на его отдельные участки от места возникновения.
3. Иррадиирующая боль, ощущается не в области воздействия, а там, где находится другая ветвь возбужденного нерва.
4. Отраженная боль, ощущается в поверхностных участках кожи, которые иннервируются из того же самого сегмента спинного мозга, что и внутренние органы, порождающее ноцицептивное воздействие. Первоначально возбуждение возникает на ноцицепторах пораженных внутренних органов, затем оно проецируется за пределы больного органа, в области различных участков кожи либо в другие органы. За отраженные боли несут ответственность интернейроны спинного мозга, на которых конвергируют (сходятся) возбуждения с внутренних органов и кожных участков. Болевое возбуждение, возникающее во внутреннем органе, активирует общий интернейрон, и от него возбуждение бежит по тем же проводящим путям, что и при раздражении кожи. Боль может отражаться на участках, значительно удаленных от породившего её органа.
5. Фантомная боль, возникает после удаления органа (ампутации). Ответственность за нее несут стойкие очаги возбуждения, расположенные в ноцицептивных структурах ЦНС. Обычно это сопровождается дефицитом торможения в ЦНС. Поступая в кору головного мозга, возбуждение от генератора этого возбуждения (болевого нервного центра) воспринимается как длительная, непрерывная и мучительная боль.
Видео: Ноцицепция
Видео: Перцепция боли мозгом
Болевые рецепторы (ноцирецепторы)
Ноцицепторы - специфические рецепторы, при возбуждении которых возникают болевые ощущения. Это свободные нервные окончания, которые могут быть расположены в любых органах и тканях и связаны с проводниками болевой чувствительности. Эти нервные окончания + проводники болевой чувствительности = сенсорная болевая единица. Большинство ноцицепторов имеет двойной механизм возбуждения, т. е. могут возбуждаться под действием повреждающих и неповреждающих агентов.
Периферический отдел анализатора представлен рецепторами боли, которые по предложению Ч. Шеррингтона называют ноцицепторами (от лат. разрушать). Это высокопороговые рецепторы, реагирующие на разрушающие воздействия.
Болевые рецепторы являются свободными окончаниями чувствительных миелиновых и безмиелиновых нервных волокон, расположенных в коже, слизистых оболочках, надкостнице, зубах, мышцах, органах грудной и брюшной полости и других органах и тканях. Число ноцирецепторов в коже человека примерно 100-200 на 1 кв. см. кожной поверхности. Общее число таких рецепторов достигает 2-4 млн.
По механизму возбуждения ноцицепторы делят на следующие основные виды болевых рецепторов:
- 1. Механоноцицепторы: реагируют на сильные механические раздражители, проводят быструю боль и быстро адаптируются. Механоноцицепторы расположены преимущественно в коже, фасциях, сухожилиях, суставных сумках и слизистых оболочках пищеварительного тракта. Это свободные нервные окончания миелинизированных волокон типа А-дельта со скоростью проведения возбуждения 4 - 30 м/с. Они реагируют на действие агента, вызывающего деформацию и повреждение мембраны рецептора при сжатии или растяжении тканей. Для большинства этих рецепторов характерна быстрая адаптация.
- 2. Хемоноцицепторы расположены также на коже и в слизистых оболочках, но превалируют во внутренних органах, где локализуются в стенках мелких артерий. Они представлены свободными нервными окончаниями немиелинизированных волокон типа С со скоростью проведения возбуждения 0,4 - 2 м/с. Специфическими раздражителями для этих рецепторов являются химические вещества (алгогены), но только те, которые отнимают кислород у тканей, нарушают процессы окисления.
Выделяют три типа алгогенов, каждый из которых имеет собственный механизм активации хемоноцицепторов.
Тканевые алгогены (серотонин, гистамин, ацетилхолин и др.) образуются при разрушении тучных клеток соединительной ткани и, попадая в интерстициальную жидкость, непосредственно активируют свободные нервные окончания.
Плазменные алгогены (брадикинин, каллидин и простагландины), выполняя роль модуляторов, повышают чувствительность хемоноцицепторов к ноцигенным факторам.
Тахикинины выделяются при повреждающих воздействиях из окончаний нервов (к ним относится вещество П - полипептид), они воздействуют местно на мембранные рецепторы того же нервного окончания.
3. Термоноцицепторы: реагируют на сильные механические и тепловые (более 40 градусов) раздражители, проводят быструю механическую и термическую боль, быстро адаптируются.
Боль является симптомом многих заболеваний и повреждений организма. У человека сформировался сложный механизм восприятия боли, который сигнализирует о повреждениях и заставляет принимать меры к устранению причин боли (одёрнуть руку и др.).
Ноцицептивная система
За восприятие и проведение боли в организме отвечает так называемая ноцицептивная система . В упрощённом виде механизм проведения боли можно представить следующим образом (рисунок ⭣).
При раздражении болевых рецепторов (ноцицепторов), локализованных в различных органах и тканях (кожа, сосуды, скелетные мышцы , надкостница и др.), возникает поток болевых импульсов, которые по афферентным волокнам поступают в задние рога спинного мозга.
Афферентные волокна бывают двух типов: А-дельта волокна и С-волокна.
А-дельта волокна являются миелинизированными, а значит, быстропроводящими - скорость проведения импульсов по ним составляет 6-30 м/с. А-дельта волокна отвечают за передачу острой боли. Они возбуждаются высокоинтенсивными механическими (булавочный укол) и иногда термическими раздражениями кожи. Имеют скорее информационное значение для организма (заставляют отдёрнуть руку, отпрыгнуть и др.).
Анатомически А-дельта ноцицепторы представлены свободными нервными окончаниями, разветвлёнными в виде дерева. Они располагаются преимущественно в коже и в обоих концах пищеварительного тракта. Имеются они также и в суставах. Трансмиттер (передатчик нервного сигнала) А-дельта волокон остаётся неизвестным.
С-волокна - немиелинизированные; они проводят мощные, но медленные потоки импульсации со скоростью 0,5-2 м/с. Считается, что эти афферентные волокна предназначены для восприятия вторичной острой и хронической боли.
С-волокна представлены плотными некапсулированными гломерулярными тельцами. Они являются полимодальными ноцицепторами, поэтому реагируют как на механические, так на температурные и химические раздражения. Активируются они химическими веществами, возникающими при повреждении тканей, являясь одновременно хеморецепторами, считаются оптимальными тканеповреждающими рецепторами.
С-волокна распределяются по всем тканям за исключением центральной нервной системы. Волокна, имеющие рецепторы, воспринимающие повреждения тканей, содержат субстанцию Р, выступающую в качестве трансмиттера.
В задних рогах спинного мозга происходит переключение сигнала с афферентного волокна на вставочный нейрон, с которого, в свою очередь, импульс ответвляется, возбуждая мотонейроны. Данное ответвление сопровождается двигательной реакцией на боль - отдёрнуть руку, отпрыгнуть и т.д. Со вставочного нейрона поток импульсов, поднимаясь далее по ЦНС, проходит через продолговатый мозг, в котором находится несколько жизненно важных центров: дыхательный, сосудодвигательный, центры блуждающего нерва, центр кашля, рвотный центр. Именно поэтому боль в некоторых случаях имеет вегетативное сопровождение - сердцебиение, потоотделение, скачки артериального давления, слюнотечение и т.д.
Далее болевой импульс достигает таламуса. Таламус является одним из ключевых звеньев передачи болевого сигнала. В нём находятся так называемые переключающие (ПЯТ) и ассоциативные ядра таламуса (АЯТ). Эти образования имеют определённый, достаточно высокий порог возбуждения, который могут преодолеть далеко не все болевые импульсы. Наличие такого порога имеет очень важное значение в механизме восприятия боли, без него любое малейшее раздражение вызывало бы болевое ощущение.
Тем не менее, если импульс достаточно сильный, он вызывает деполяризацию клеток ПЯТ, импульсы от них поступают в двигательные зоны коры головного мозга, определяя само ощущение боли. Такой путь проведения болевых импульсов называет специфическим. Он обеспечивает сигнальную функцию боли - организм воспринимает факт возникновения боли.
В свою очередь, активация АЯТ обусловливает попадание импульсов в лимбическую систему и гипоталамус, обеспечивая эмоциональную окраску боли (неспецифический путь проведения боли). Именно из-за этого пути проведения восприятие боли имеет психоэмоциальную окраску. Кроме того, благодаря этому пути люди могут описывать воспринимаемую боль: острая, пульсирующая, колющая, ноющая и т.д., что определяется уровнем воображения и типом нервной системы человека.
Антиноцицептивная система
На всем протяжении ноцицепгивной системы присутствуют элементы антиноцицептивной системы, которая также является неотъемлемой частью механизма восприятия боли. Элементы этой системы призваны подавлять болевые ощущения. В механизмах развития анальгезии, подконтрольным антиноцицептивной системе, участвуют серотонинэргическая, ГАМК-эргическая и, в наибольшей степени, - опиоидная система. Функционирование последней реализуется за счёт белковых трансмиттеров - энкефалинов, эндорфинов - и специфических для них опиоидных рецепторов.
Энкефапины (мет-энкефалин - H-Tyr-Gly-Gly-Phe-Met-OH, лей-энкефалин - H-Tyr-Gly-Gly-Phe-Leu-OH и др.) впервые были выделены в 1975 г. из мозга млекопитающих. По своей химической структуре относятся к классу пентапептидов, имея очень близкое строение и молекулярную массу. Энкефалины являются нейромедиаторами опиоидной системы, функционируют на всем ее протяжении от ноцицепторов и афферентных волокон до структур головного мозга.
Эндорфины (β-эндофин и динорфин) - гормоны, продуцируемые кортикотропными клетками средней доли гипофиза. Эндорфины имеют более сложное строение и большую молекулярную массу, чем энкефалины. Так, β-эндофин синтезируется из β-липотропина, являясь, по сути, 61-91 аминокислотной частью этого гормона.
Энкефалины и эндорфины, стимулируя опиоидные рецепторы, осуществляют физиологическую антиноцицепцию, причём энкефалины следует рассматривать как нейромедиаторы, а эндорфины - как гормоны.
Опиоидные рецепторы - класс рецепторов, которые, являясь мишенями для эндорфинов и энкефалинов, участвуют в реализации эффектов антиноцицептивной системы. Их название произошло от опия - высушенного млечного сока мака снотворного, известного с древних времен источника наркотических анальгетиков.
Выделяют 3 основных типа опиоидных рецепторов: μ (мю), δ (дельта), κ (каппа). Их локализация и эффекты, возникающие при их возбуждении, представлены в таблице ⭣.
| Локализация | Эффект при возбуждении | |
| μ-рецепторы: | ||
| Антиноцицептивная система | ➔ | Анальгезия (спинальная, супраспинальная), эйфория, пристрастие. |
| Кора головного мозга | ➔ | Торможение коры, сонливость. Косвенно - брадикардия, миоз. |
| Дыхательный центр | ➔ | Угнетение дыхания. |
| Центр кашля | ➔ | Угнетение кашлевого рефлекса. |
| Рвотный центр | ➔ | Стимуляция рвотного центра. |
| Гипоталамус | ➔ | Угнетение центра терморегуляции. |
| Гипофиз | ➔ | Ослабление выработки гонадотропных гормонов и усиление выработки пролактина и антидиуретического гормона. |
| Желудочно-кишечный тракт | ➔ | Снижение перистальтики, спазм сфинктеров, ослабление секреции желез. |
| δ-рецепторы: | ||
| Антиноцицептивная система | ➔ | Анальгезия. |
| Дыхательный центр | ➔ | Угнетение дыхания. |
| κ-рецепторы: | ||
| Антиноцицептивная система | ➔ | Анальгезия, дисфория. |
Энкефалины и эндорфины, стимулируя опиоидные рецепторы, вызывают активацию связанного с этими рецепторами G₁-белка. Данный белок ингибирует фермент аденилатциклазу, которая в обычных условиях способствует синтезу циклического аденозинмонофосфата (цАМФ). На фоне её блокады количество цАМФ внутри клетки снижается, что приводит к активации мембранных калиевых каналов и блокаде кальциевых каналов.
Как известно, калий - это внутриклеточный ион, кальций - внеклеточный ион. Указанные изменения в работе ионных каналов обусловливают выход ионов калия из клетки, притом что кальций внутрь клетки войти не может. В результате заряд мембраны резко снижается, и развивается гиперполяризация - состояние, при котором клетка не воспринимает и не передаёт возбуждение. Как следствие возникает подавление ноцицептивной импульсации.
Источники:
1. Лекции по фармакологии для высшего медицинского и фармацевтического образования / В.М. Брюханов, Я.Ф. Зверев, В.В. Лампатов, А.Ю. Жариков, О.С. Талалаева - Барнаул: изд-во Спектр, 2014.
2. Общая патология человека / Саркисов Д.С., Пальцев М.А., Хитров Н.К. - М.: Медицина, 1997.
|
Ярослав Алексеевич Андреев - кандидат биологических наук, старший научный сотрудник лаборатории нейрорецепторов и нейрорегуляторов отдела молекулярной нейробиологии Института биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова РАН. Научные интересы связаны с поиском и характеристикой модуляторов болевых рецепторов. |
|
Юлия Александровна Логашина - младший научный сотрудник той же лаборатории. Занимается поиском и характеристикой новых лигандов TRPA1 рецептора. |
|
Ксения Игоревна Лубова - студентка биологического факультета Московского государственного университета им. М. В. Ломоносова. Изучает TRP рецепторы и их модуляторы. |
|
Александр Александрович Василевский - кандидат химических наук, руководитель группы молекулярных инструментов для нейробиологии отдела молекулярной нейробиологии Института биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова РАН. Специалист в области ионных каналов и природных токсинов. |
|
Сергей Александрович Козлов - доктор химических наук, руководитель лаборатории нейрорецепторов и нейрорегуляторов того же отдела. Область научных интересов - белковые рецепторы в нервной системе и их лиганды. |
Говорят, что жизнь - это боль. Хотя в этой фразе содержится нечто негативное, связанное с неприятными ощущениями, переживаниями или даже тяжелыми страданиями, не стоит забывать, что боль (ноцицепция) предупреждает нас об опасности - сигнализирует о нарушениях в организме, который немедленно принимается их устранять. Вместе с тем существует и боль, которая приносит только мучения.
Основная причина появления такой боли - сбои в передаче болевых сигналов (нервных импульсов) от чувствительных нейронов к головному мозгу, который и формирует неприятные ощущения. Когда воздействие неопасных стимулов распознающие нейроны расценивают как опасное, развивается состояние, которое называется гиперчувствительностью. И это не всегда плохо, так как в нужный момент она играет важную роль в процессе выздоровления и восстановления организма. Однако бывает и так, что реального повода нет, а гиперчувствительность ведет к изнурительной хронической боли. В таком случае самые обычные безобидные стимулы (легкое прикосновение или тепло) вызывают аллодинию (от греч. άλλος - другой и οδύνη - мучение), а болезненные стимулы - боль еще большей интенсивности, гиперальгезию (от греч. ὑπέρ - сверх- и ἄλγος - боль). Часто аномально интенсивная и нередко хроническая боль, которая изматывает и физиологически, и психологически, а также затрудняет выздоровление, возникает в результате таких заболеваний, как артрит, опоясывающий лишай, СПИД, рак костей и др.
Прежде чем винить в аномалиях чувствительные нейроны (ноцицепторы), которые воспринимают, анализируют и передают болевые сигналы, разберемся, как они работают в здоровом организме и что происходит при патологиях.
Почему так больно?
Биологическая функция ноцицепторов состоит не только в регистрации раздражителя и сообщении об этом нашему мозгу, но и в восприятии сигналов от ближайших соседей. Нейроны окружены другими клетками организма и межклеточной средой, за сохранность и правильное функционирование которых отвечает наша нервная система. Поэтому у ноцицепторов имеется множество молекулярных сенсоров (или рецепторов), настроенных на распознавание химических раздражителей, изменения состава и свойств межклеточной среды, выброса сигнальных молекул из близлежащих клеток. Нейрон самостоятельно «вычисляет» вклад каждого такого молекулярного сенсора по силе и длительности стимуляции, и, если стимулы расцениваются как нежелательные, сигнализирует об этом - и нам становится больно; это «нормальная» физиологическая боль (ноцицепция). Патологическая боль возникает как в случае гибели нейронов при повреждении проводящей сети периферической или центральной нервной системы, так и при ошибочной работе самих нейронов, а ошибаются они из-за неправильной работы их сенсоров.
Болевые сенсоры (или рецепторы) - это мембранные белки, которые распознают физическое или химическое воздействие на мембрану нейрона. При этом они являются катион-селективными ионными каналами, то есть обеспечивают проведение положительно заряженных ионов (натрия, калия, кальция) через клеточную мембрану. Активация рецепторов приводит к открытию катионных каналов и возбуждению чувствительных нейронов - возникновению нервного импульса. Подробнее о наиболее изученных болевых рецепторах мы расскажем ниже.
Что происходит, когда, предположим, человек по неосторожности обжег руку горячим предметом? Такое опасное температурное воздействие регистрируют рецепторы, которые располагаются в мембране ноцицептора. Они мгновенно распознают сильную стимуляцию и передают импульс в центральную нервную систему. На столь сильное возбуждение мозг незамедлительно реагирует, и мы рефлекторно отдергиваем руку от горячего предмета. Интересно, что те же сенсоры реагируют на капсаицин - активное вещество жгучего перца, вызывающего «пожар» во рту.
За распознавание ряда опасных химических воздействий отвечают другие рецепторы, которые воспринимают стимулы только с внутриклеточной стороны, поэтому для их активации опасные вещества должны не только проникнуть через кожу, но и попасть внутрь нейрона, «пробравшись» через липидную биомембрану. Если химический ожог вызван кислотой, то работать будет именно тот рецептор, который чувствителен к изменению кислотности среды, и тоже даст сильный ответ, как только кислота достигнет нейрона.
Руку мы отдернули, но за время контакта с горячей поверхностью часть наших клеток погибла, и в ответ на повреждение ткани у нас начинает развиваться воспалительный процесс. В этом тоже принимает участие наша нервная система. Из поврежденных клеток через разорванные цитоплазматические мембраны во внеклеточную среду начинают выделяться характерные для внутриклеточной среды молекулы, в частности аденозинтрифосфорной кислоты (АТФ). На этот случай в нейронах тоже есть свой рецептор, который активируется молекулами АТФ и сигнализирует о том, что рядом с ним произошла гибель клеток и требуется их восстановление. Дело в том, что АТФ, как известно еще со школы, - основная энергетическая молекула организма, и такая «ценность» редко оказывается в межклеточной среде.
Нейрон не просто сигнализирует, он выбрасывает во внеклеточную среду особые биологически активные соединения, медиаторы воспаления, что приводит к длительному развитию нейрогенного воспаления - расширению сосудов и привлечению клеток иммунной системы. Пока идет процесс регенерации и в среде присутствуют медиаторы воспаления, сенсорные нейроны посылают сигнал в центральную нервную систему, где он тоже воспринимается как боль, но уже не такая сильная. Так как поврежденная ткань нуждается в защите, чувствительность нейронов к внешним воздействиям повышается, и даже незначительное механическое или тепловое воздействие будет вызывать сильную болевую реакцию. Это и есть «полезная» гиперчувствительность.
Почти все знают, что к поврежденной ткани рекомендуется приложить холод, чтобы облегчить боль и уменьшить воспаление. В этом эффекте также задействованы нейрональные рецепторы. Главный рецептор «по холоду» - ментоловый (помните «мятный» холодок?) - находится не в тех же нейронах, где располагается «тепловой», а потому ощущения холода и жары передаются различными чувствительными волокнами. Оказывается, информация от разных ноцицепторов «суммируется» в спинном мозгу, сигнал от горячего воздействия корректируется с учетом сигнала от холодного, и именно поэтому приложенный кусочек льда может унять сильную боль.
Описанная схема развития боли сильно упрощена (рис. 1). На самом деле, чтобы разобраться в деталях ноцицепции, ученые исследуют каждый рецептор отдельно в изолированных условиях. Эксперименты проводят на клеточных линиях, в которые методами генной инженерии встраивают гены определенных рецепторов. Расскажем немного об изучении и функциях нескольких наиболее важных болевых рецепторов. Как оказалось, они не всегда ориентированы на распознавание и генерацию болевого сигнала, но вовлечены в регуляцию многих других процессов, поэтому умение корректировать их работу различными лекарственными препаратами поможет лечить разнообразные болезни (рис. 2).

Рецепторы температуры и химических раздражителей
Очень часто в развитии боли и воспаления играют роль чувствительные нейроны, которые отвечают за восприятие высокой температуры. Еще в середине XX века обнаружили, что большие дозы капсаицина вызывают у экспериментальных животных новый тип обезболивания (анальгезии) . После введения капсаицина вначале наблюдается характерная поведенческая реакция, вызванная болью, но затем наступает длительный период потери чувствительности к ряду внешних стимулов. Животные в таком состоянии нормально реагируют на мягкое механическое раздражение, но утрачивают реакцию на многие болевые стимулы, и у них не развивается нейрогенное воспаление. Таким образом, нейроны, отвечающие за восприятие высокой температуры, также отвечают за восприятие химических раздражителей и нейрогенный компонент воспалительного ответа . Стало очевидно, что рецептор, который реагирует на воздействие температуры и капсаицина, может оказаться полезной мишенью для поиска средств, направленных на лечение воспаления и боли . В конце ХХ в. этот рецептор был охарактеризован на молекулярном уровне и назван TRPV1 (от англ. transient receptor potential channel vanilloid family member 1 - первый представитель ванилоидного семейства рецепторов переменного рецепторного потенциала), или проще - ванилоидный рецептор 1 (рис. 3) . Название «ванилоидные рецепторы» дано не случайно: TRPV1 и другие представители семейства активируются химическими соединениями, содержащими ванилиновую группу (например, капсаицином). Установлено, что TRPV1 - катион-селективный ионный канал, который активируется различными стимулами (температурой выше 43°C, низким рН, капсаицином), а кроме того, его активность регулируется медиаторами воспаления, правда, не напрямую, а через внутриклеточных посредников. Мыши, нокаутные по гену TRPV1 (то есть такие, у которых ген этого рецептора отсутствует или поврежден так, что не работает), значительно медленнее реагируют на тепло, и у них почти не появляется тепловая гиперчувствительность при воспалении . TRPV1 играет важную роль в ряде патологических состояний: при болях, вызванных воспалительным процессом, при онкологических, нейропатических и висцеральных болях, а также при заболеваниях дыхательных путей, панкреатите и мигрени.

Исследования TRPV1 привели к интенсивному изучению подобных рецепторов. Так, был обнаружен еще один ванилоидный рецептор - TRPV3. Интересно, что он реагирует как на приятное тепло, так и на болезненный жар: активность TRPV3 регистрируется при температуре выше 33°C, причем его ответ сильнее на более высокую температуру и возрастает при повторяющейся тепловой стимуляции. Помимо температуры, этот рецептор также активируется камфорой, едкими экстрактами тимьяна, орегано и гвоздики. TRPV3 - еще один кандидат на роль участника в болевой гиперчувствительности, его активность регулируется медиаторами воспаления. Наконец, он напрямую активируется оксидом азота II (NO) - вторичным мессенджером, обеспечивающим увеличение чувствительности нейронов к стимуляции. Также следует отметить наличие TRPV3 в клетках кожи кератиноцитах, где его активация приводит к выбросу воспалительного медиатора интерлейкина-1, что подчеркивает важную роль этого рецептора в воспалительных заболеваниях кожи .
TRP-рецепторы - тетрамеры (рис. 3), то есть образованы четырьмя полипептидными цепочками. При этом могут собираться как гомомеры, то есть рецепторы, сформированные одинаковыми цепочками (например, TRPV1 или TRPV3, описанные выше), так и гетеромеры из разных цепей. Гетеромерные рецепторы (например, построенные из цепочек TRPV1 и TRPV3) обладают различной чувствительностью к тепловым стимулам, пороговая температура их активации лежит между значениями, пороговыми для гомомерных рецепторов.
Интересна история открытия холодового рецептора TRPM8 (здесь «M» означает «меластатин», что указывает на функцию рецепторов этого семейства в меланоцитах - клетках кожи, ответственных за пигментацию). Вначале был обнаружен кодирующий его ген, активность которого повышалась при раке простаты и некоторых других онкологических заболеваниях . Много позже была показана способность TRPM8 реагировать на ментол (компонент мяты) и ряд других «освежающих» веществ, а также на понижение температуры (ниже 26°С). Теперь этот рецептор считается основным сенсором холода в нервной системе . Исследования выявили, что TRPM8 отвечает за широкий диапазон восприятия холодовых стимулов - от приятной прохлады до болезненного холода и холодовой гиперчувствительности. Такое разнообразие функций объясняется существованием нескольких субпопуляций чувствительных нейронов, которые используют TRPM8 как многофункциональный сенсор холода, настроенный на определенную температуру при участии внутриклеточных сигнальных систем.
Самый непонятный и очень важный рецептор TRPA1 (здесь «A» означает «анкирин», что указывает на наличие в структуре рецепторов этого семейства большого числа «анкириновых повторов», особых белковых элементов) находят в чувствительных нейронах кожи, клетках эпителия кишечника, легких и мочевого пузыря, причем TRPA1 часто соседствует с TRPV1 . Вещества, активирующие TRPA1, вызывают жжение, механическую и термическую гиперчувствительность, а также нейрогенное воспаление. Гиперэкспрессия гена, кодирующего TRPA1, ведет к возникновению хронического кожного зуда и аллергического дерматита. Наследственное заболевание «синдром эпизодической боли», которое характеризуется неожиданно возникающей изнурительной болью при голодании или физической нагрузке, связано с мутацией в этом рецепторе, приводящей к его избыточной активности .
Основная функция TRPA1 - распознавание химических и воспалительных агентов, и их ассортимент столь велик, что с правильной работой этого рецептора связаны почти все жизненные процессы нашего организма. В дыхательной системе он распознает летучие вредные вещества: слезоточивый газ, озон, альдегиды (акролеин, компоненты корицы), сераорганические соединения (жгучие компоненты горчицы, лука и чеснока), вызывая кашель, чихание и образование слизи. В кишечнике TRPA1 регистрирует присутствие воспалительных агентов. Гиперактивность мочевого пузыря при диабете вызвана активацией этого рецептора акролеином, который накапливается в моче. Выявлено участие TRPA1 в возникновении мигрени под влиянием сигаретного дыма и формальдегида у некоторых людей .
Воздействие на рецепторы чувствительных нейронов, участвующие в восприятии температуры, с помощью лекарственных средств приводит к облегчению боли и воспаления. Именно так, не зная о молекулярных мишенях, народная медицина в разное время применяла настойки перца (TRPV1), горчицы (TRPA1), мяты (TRPM8) и гвоздики (TRPV3) для лечения ряда воспалительных заболеваний.
Пуриновые рецепторы
Мы уже упоминали, что организму очень важно знать о повреждении тканей. При травмах, когда нарушается целостность органов и происходит гибель клеток, при ишемии или воспалении в межклеточное пространство попадают молекулы АТФ. Этот кофермент множества реакций обеспечивает энергией многие процессы в клетке; он слишком ценен для функционирования клеток, поэтому редко выбрасывается за их пределы. Восприятие повышения локальной концентрации АТФ осуществляют пуринергические рецепторы (P2X), являющиеся катион-селективными ионными каналами, они запускают болевой ответ, возникающий вследствие разрушения тканей, деформации органов и развития опухолей . Для чувствительных нейронов характерны подтипы P2X2 и P2X3, важная роль последнего в развитии боли при воспалении показана в исследованиях на нокаутных мышах. Также известно, что P2X-рецепторы имеют принципиальное значение для многих физиологических процессов, таких как регуляция тонуса сосудов, вкусовая рецепция и т.д.
Рецепторы кислоты
Для регистрации кислотности во многих типах клеток нервной системы присутствуют так называемые кислоточувствительные ионные каналы (acid-sensing ion channels , ASIC). Считается, что они осуществляют передачу сигнала, связанного с локальным изменением рН при нормальной нейрональной активности в центральной нервной системе. Однако задействованы они и в патологических процессах. В последнее время рецептор подтипа ASIC1a рассматривается как один из основных факторов гибели нейронов в центральной нервной системе при ишемических состояниях. При ишемии и гипоксии усиливается гликолиз, в результате чего происходит накопление молочной кислоты и последующее «закисление» ткани. «Выключение» рецептора ASIC1a вызывает нейропротекторное действие в модели ишемии, что было показано на нокаутных мышах . В периферической нервной системе и тканях внутренних органов ASIC ответственны за чувствительность к боли, возникающей при тканевом ацидозе в мышцах, при сердечной ишемии, повреждении роговицы, воспалении, новообразованиях и местной инфекции . В нейронах периферической нервной системы в основном представлены рецепторы подтипа ASIC3, активность которых также необходимо понижать для купирования боли.
В отличие от TRP-рецепторов, P2X-рецепторы и ASIC являются тримерами (рис. 3), т.е. собраны из трех полипептидных цепочек. Но точно так же эти рецепторы могут быть гомомерами и гетеромерами, что увеличивает их разнообразие и спектр выполняемых функций.
Как победить боль?
Так что же делать, если мы испытываем боль? Если это боль острая или хроническая, терпеть ее нельзя, и необходимо использовать обезболивающие средства, чтобы вернуть нашу систему ноцицепции в нормальное состояние, а себя - к жизни в самом прямом смысле этого слова. В настоящее время для обезболивания применяется множество лекарственных препаратов различных фармакологических групп. Основное место в этом ряду занимают нестероидные противовоспалительные средства (НПВС), антиконвульсанты и антидепрессанты, а также наркотические анальгетики (морфин и другие опиаты и опиоиды). Имеющиеся в настоящее время анальгетические средства влияют главным образом на пути передачи и распространения боли. Для специфичного регулирования рецепторов боли, описанных выше, пока препаратов на рынке лекарств нет.
Первой «болевой» мишенью для фармацевтических компаний стал рецептор TRPV1, поскольку содержащие его чувствительные нейроны играют роль интеграторов многих стимулов, воспринимающихся как боль. Скрининг химических библиотек и рациональный дизайн лигандов на основе знаний о сайте связывания капсаицина позволили создать значительное количество высокоэффективных низкомолекулярных ингибиторов TRPV1. Эти соединения обладали обезболивающим эффектом, но приводили к развитию гипертермии - повышению температуры тела (на 1,5–3°С). Гипертермия стала основной причиной отказа фармакологических компаний от развития лекарственных препаратов на основе полных антагонистов рецептора TRPV1. Однако если ингибировать этот рецептор лишь частично, повышения температуры тела можно избежать. И такие частичные ингибиторы TRPV1 нам, под руководством академика Е. В. Гришина (1946–2016), удалось найти в яде морской анемоны Heteractis crispa . В яде анемоны обнаружено сразу три пептида, ингибирующих TRPV1 и не повышающих температуру тела [ , ], но наиболее мягким эффектом обладал пептид, получивший название АРНС3. Он имеет сильный анальгетический эффект в дозах 0,01–0,1 мг/кг массы тела и слабо понижает температуру тела (всего на 0,6°С) . По силе обезболивания он сопоставим с морфином, но не вызывает наркотического действия и привыкания. По данным доклинических исследований, пептид полностью пригоден для дальнейших клинических испытаний, так как никакие побочные эффекты на лабораторных животных не были обнаружены. Более того, понижение температуры тела необходимо, например, для обеспечения нейропротекции у выживших после остановки сердца, и гипотермическое действие пептида может служить дополнительным бонусом.
Работая под руководством Гришина, мы также обнаружили ингибитор P2X3-рецепторов. Это тоже оказался пептид, которому было дано имя PT1, а найден он был в яде паука Alopecosa marikovskyi . Кстати, PT1 уже успешно прошел лабораторные и доклинические испытания, так что через какое-то время он вполне может стать одним из первых принципиально новых анальгетиков, специфично ингибирующих «болевые» рецепторы. Для третьего из упомянутых подобных рецепторов, ASIC3, нами также был найден ингибитор: пептид Ugr 9-1; источником стал яд морской анемоны Urticina grebelnyi .
Заметим, что в природных ядах часто находят токсины с обратным эффектом, то есть вещества, активирующие рецепторы боли. С точки зрения биологии ядовитых животных это понятно: «болевые» токсины используются ими в целях защиты. Например, в яде китайского птицееда Haplopelma schmidti содержится сильнейший активатор TRPV1, а из яда техасской коралловой змеи Micrurus tener получен активатор ASIC1a. Сейчас уже научились извлекать пользу из таких веществ: их применяют как молекулярные инструменты, чтобы «замораживать» болевые рецепторы в активированном состоянии и исследовать их структуру (рис. 3) [ , ]. С другой стороны, обнаружение полезных молекул в природных ядах - тоже довольно распространенное явление, и несколько природных токсинов (или веществ, созданных на их основе) сегодня применяются в медицине как лекарства. Вот где обретает особый смысл известное изречение средневекового алхимика Парацельса: «Все есть яд, и ничто не лишено ядовитости; одна лишь доза делает яд незаметным».
Рецепторы чувствительных нейронов представляют собой заманчивую, но сложную мишень для создания лекарств. Препараты, если они обладают хорошей селективностью к этим рецепторам, будут приняты потребителями с большой радостью, так как почти все современные средства ограничены в применении из-за побочных эффектов. Работы по поиску селективных препаратов ведутся, в том числе и в нашей стране, и при благоприятном стечении обстоятельств такие лекарства уже скоро смогут появиться в аптеках. Долгих вам лет жизни без боли!
Работа выполнена при поддержке Российского научного фонда (проект № 14-24-00118).
Литература
.
Palermo N. N., Brown H. K., Smith D. L. Selective neurotoxic action of capsaicin on glomerular C-type terminals in rat substantia gelatinosa // Brain Res.
1981. V. 208. P. 506–510.
.
O’Neill J., Brock C., Olesen A. E. et al.
Это первый из описанных врачами Древней Греции и Рима симптомов – признаков воспалительного повреждения. Боль – это то, что сигнализирует нам о каком-либо неблагополучии, возникающем внутри организма или о действии некоего разрушающего и раздражающего фактора извне.
Боль, по мнению широко известного русского физиолога П. Анохина, призвана мобилизовывать разнообразные функциональные системы организма для его защиты от воздействия вредящих факторов. Боль включает в себя такие компоненты как: ощущение, соматические (телесные), вегетативные и поведенческие реакции, сознание, память, эмоции и мотивации. Таким образом, боль есть объединяющая интегративная функция целостного живого организма. В данном случае – человеческого организма. Ибо живые организмы, даже не обладая признаками высшей нервной деятельности, могут испытывать боль.
Имеются факты изменения электрических потенциалов у растений, которые фиксировались при повреждении их частей, а также такие же электрические реакции, когда исследователи наносили травму соседним растениям. Таким образом, растения реагировали на причиняемые им или соседним растениям повреждения. Только боль имеет такой своеобразный эквивалент. Вот такое интересное, можно сказать, универсальное свойство всех биологических организмов.
Виды боли – физиологическая (острая) и патологическая (хроническая).
Боль бывает физиологической (острой) и патологической (хронической) .Острая боль
По образному выражению академика И.П. Павлова, является важнейшим эволюционным приобретением, и требуется для защиты от воздействия разрушающих факторов. Смысл физиологической боли заключается в отбрасывании всего, что угрожает жизненному процессу, нарушает равновесие организма с внутренней и внешней средой.Хроническая боль
Это явление несколько более сложное, которое формируется в результате длительно существующих в организме патологических процессов. Процессы эти могут быть как врожденными, так и приобретенными в течение жизни. К приобретенным патологическим процессам относят следующие – длительное существование очагов воспаления, имеющих различные причины, всевозможные новообразования (доброкачественные и злокачественные), травматические повреждения, операционные вмешательства, исходы воспалительных процессов (например, образование спаек между органами, изменение свойств тканей, входящих в их состав). К врожденным патологическим процессам относятся следующие – различные аномалии расположения внутренних органов (например, расположение сердца снаружи грудной клетки), врожденные аномалии развития (например, врожденный дивертикул кишечника и прочие). Таким образом, длительно существующий очаг повреждения, приводит к постоянным и небольшим повреждениям структур организма, что также постоянно создает болевую импульсацию о повреждениях данных структур организма, затронутых хроническим патологическим процессом.Так как данные повреждения минимальны, то и болевые импульсы довольно таки слабые, а боль становится постоянной, хронической и сопровождает человека повсеместно и практически круглосуточно. Боль становится привычной, однако никуда не исчезает и остается источником длительного раздражающего воздействия. Болевой синдром, существующий у человека шесть или более месяцев, приводит к значительным изменениям в организме человека. Происходит нарушение ведущих механизмов регуляции важнейших функций организма человека, дезорганизация поведения и психики. Страдает социальная, семейная и личностная адаптация данного конкретного индивида.
Как часто встречаются хронические боли?
Согласно исследованиям Всемирной Организации Здравоохранения (ВОЗ), каждый пятый житель планеты страдает хроническими болями, причиняемыми всевозможными патологическими состояниями, связанными с заболеваниями различных органов и систем организма. Это означает, что как минимум 20% людей страдают хроническими болями разной степени выраженности, различной интенсивности и длительности.
Что такое боль и как она возникает? Отдел нервной системы ответственный за передачу болевой чувствительности, вещества вызывающие и поддерживающие болевые ощущения.
Ощущение боли представляет собой сложный физиологический процесс, включающий периферические и центральные механизмы, и имеющий эмоциональную, психическую, а зачастую и вегетативную окраску. Механизмы болевого феномена полностью на сегодняшний день не раскрыты, несмотря на многочисленные научные исследования, которые продолжаются вплоть до сегодняшнего времени. Однако рассмотрим основные этапы и механизмы восприятия боли.Нервные клетки, передающие болевой сигнал, виды нервных волокон.
 Самый первый этап восприятия боли представляет собой воздействие на болевые рецепторы (ноцицепторы
). Данные болевые рецепторы расположены во всех внутренних органах, костях, связках, в коже, на слизистых оболочках различных органов, соприкасающихся с внешней средой (например, на слизистой кишечника, носа, горла и т.д.).
Самый первый этап восприятия боли представляет собой воздействие на болевые рецепторы (ноцицепторы
). Данные болевые рецепторы расположены во всех внутренних органах, костях, связках, в коже, на слизистых оболочках различных органов, соприкасающихся с внешней средой (например, на слизистой кишечника, носа, горла и т.д.).На сегодняшний день выделяют два основных вида болевых рецепторов: первые – это свободные нервные окончания, при раздражении которых возникает ощущение тупой, разлитой боли, а вторые представляют собой сложные болевые рецепторы, при возбуждении которых возникает чувство острой и локализованной боли. То есть характер болевых ощущений напрямую зависит от того, какие болевые рецепторы восприняли раздражающее воздействие. Относительно специфических агентов, которые могут раздражать болевые рецепторы, можно сказать, что к ним относятся различные биологически активные вещества (БАВ) , образующиеся в патологических очагах (так называемые, алгогенные вещества ). К данным веществам относятся различные химические соединения – это и биогенные амины, и продукты воспаления и распада клеток, и продукты локальных иммунных реакций. Все эти вещества, совершенно разные по химической структуре, способны оказывать раздражающее действие на болевые рецепторы различной локализации.
Простагландины – вещества, поддерживающие воспалительную реакцию организма.
Однако, существует ряд химических соединений, участвующих в биохимических реакциях, которые сами непосредственно не могут воздействовать на болевые рецепторы, однако усиливают эффекты веществ вызывающих воспаление. К классу данных веществ, например, относятся простагландины. Простагландины образуются из особых веществ – фосфолипидов , которые составляют основу клеточной мембраны. Данные процесс протекает следующим образом: некий патологический агент (например, ферментов образуются простагландины и лейкотриены. Простагландины и лейкотриены в целом называются эйкозаноиды и играют важную роль в развитии воспалительной реакции. Доказана роль простагландинов в формировании болевых ощущений при эндометриозе, предменструальном синдроме, а также синдроме болезненных менструаций (альгодисменорее).Итак, мы рассмотрели первый этап формирования болевого ощущения – воздействие на специальные болевые рецепторы. Рассмотрим, что происходит дальше, каким образом человек чувствует боль определенной локализации и характера. Для понимания данного процесса необходимо ознакомиться с проводящими путями.
Как болевой сигнал поступает в головной мозг? Болевой рецептор, периферический нерв, спинной мозг, таламус – подробнее о них.
 Биоэлектрический болевой сигнал, сформировавшийся в болевом рецепторе, по нескольким типам нервных проводников (периферическим нервам), минуя внутриорганные и внутриполостные нервные узлы, направляется к спинальным нервным ганглиям (узлам)
, расположенным рядом со спинным мозгом. Эти нервные ганглии сопровождают каждый позвонок от шейных до некоторых поясничных. Таким образом, образуется цепочка нервных ганглиев, идущая справа и слева вдоль позвоночного столба. Каждый нервный ганглий связан с соответствующим участком (сегментом) спинного мозга. Дальнейший путь болевого импульса из спинальных нервных ганглиев направляется в спинной мозг, который непосредственно соединен с нервными волокнами.
Биоэлектрический болевой сигнал, сформировавшийся в болевом рецепторе, по нескольким типам нервных проводников (периферическим нервам), минуя внутриорганные и внутриполостные нервные узлы, направляется к спинальным нервным ганглиям (узлам)
, расположенным рядом со спинным мозгом. Эти нервные ганглии сопровождают каждый позвонок от шейных до некоторых поясничных. Таким образом, образуется цепочка нервных ганглиев, идущая справа и слева вдоль позвоночного столба. Каждый нервный ганглий связан с соответствующим участком (сегментом) спинного мозга. Дальнейший путь болевого импульса из спинальных нервных ганглиев направляется в спинной мозг, который непосредственно соединен с нервными волокнами.
На самом деле спинной мог – это неоднородная структура – в нем выделяют белое и серое вещество (как и в головном мозге). Если спинной мозг рассмотреть на поперечном разрезе, то серое вещество будет выглядеть как крылья бабочки, а белое будет окружать его со всех сторон, формируя округлые очертания границ спинного мозга. Так вот, задняя часть этих крылышек бабочки называется задними рогами спинного мозга. По ним нервные импульсы переправляются к головному мозгу. Передние же рога, по логике должны располагаться в передней части крыльев – так оно и происходит. Именно передние рога проводят нервный импульс от головного мозга к периферическим нервам. Так же в спинном мозге в центральной его части существуют структуры, которые непосредственно соединяют нервные клетки передних и задних рогов спинного мозга – благодаря этому имеется возможность формирования так называемой «кроткой рефлекторной дуги», когда некоторые движения происходят неосознанно - то есть без участия головного мозга. Примером работы короткой рефлекторной дуги является одергивание руки от горячего предмета.
 Поскольку спинной мозг имеет сегментарное строение, следовательно, в каждый сегмент спинного мозга входят нервные проводники со своей зоны ответственности. При наличии острого раздражителя с клеток задних рогов спинного мозга возбуждение может резко переключаться на клетки передних рогов спинномозгового сегмента, что вызывает молниеносную двигательную реакцию. Коснулись рукой горячего предмета – одернули сразу руку. При этом болевая импульсация все равно достигает коры головного мозга, и мы осознаем, что прикоснулись к горячему предмету, хотя руку уже рефлекторно отдернули. Подобные нервно-рефлекторные дуги для отдельных сегментов спинного мозга и чувствительных периферических участков могут различаться в построении уровней участия центральной нервной системы.
Поскольку спинной мозг имеет сегментарное строение, следовательно, в каждый сегмент спинного мозга входят нервные проводники со своей зоны ответственности. При наличии острого раздражителя с клеток задних рогов спинного мозга возбуждение может резко переключаться на клетки передних рогов спинномозгового сегмента, что вызывает молниеносную двигательную реакцию. Коснулись рукой горячего предмета – одернули сразу руку. При этом болевая импульсация все равно достигает коры головного мозга, и мы осознаем, что прикоснулись к горячему предмету, хотя руку уже рефлекторно отдернули. Подобные нервно-рефлекторные дуги для отдельных сегментов спинного мозга и чувствительных периферических участков могут различаться в построении уровней участия центральной нервной системы.
Как нервный импульс достигает головного мозга?
 Далее из задних рогов спинного мозга путь болевой чувствительности направляется в вышележащие отделы центральной нервной системы по двум путям – по так называемым «старым» и «новым» спиноталамическим (путь нервного импульса: спинной мозг – таламус) путям. Названия «старый» и «новый» являются условными и говорят лишь о времени появления указанных путей на историческом отрезке эволюции нервной системы. Не будем, однако, вдаваться в промежуточные этапы довольно сложного нервного пути, ограничимся лишь констатацией факта, что оба указанных пути болевой чувствительности оканчиваются в участках чувствительной коры головного мозга. И «старый», и «новый» спиноталамические пути проходят через таламус (особый участок головного мозга), а «старый» спиноталамический путь – еще и через комплекс структур лимбической системы мозга. Структуры лимбической системы мозга во многом участвуют в образовании эмоций и формировании поведенческих реакций.
Далее из задних рогов спинного мозга путь болевой чувствительности направляется в вышележащие отделы центральной нервной системы по двум путям – по так называемым «старым» и «новым» спиноталамическим (путь нервного импульса: спинной мозг – таламус) путям. Названия «старый» и «новый» являются условными и говорят лишь о времени появления указанных путей на историческом отрезке эволюции нервной системы. Не будем, однако, вдаваться в промежуточные этапы довольно сложного нервного пути, ограничимся лишь констатацией факта, что оба указанных пути болевой чувствительности оканчиваются в участках чувствительной коры головного мозга. И «старый», и «новый» спиноталамические пути проходят через таламус (особый участок головного мозга), а «старый» спиноталамический путь – еще и через комплекс структур лимбической системы мозга. Структуры лимбической системы мозга во многом участвуют в образовании эмоций и формировании поведенческих реакций.Предполагается, что первая, более эволюционно молодая система («новый» спиноталамический путь) проведения болевой чувствительности рисует более определенную и локализованную боль, вторая же, эволюционно более древняя («старый» спиноталамический путь) служит для проведения импульсов, дающих ощущение тягучей, плохо локализованной боли. Дополнительно к этому, указанная «старая» спиноталамическая система обеспечивает эмоциональное окрашивание болевого ощущения, а также участвует в формировании поведенческих и мотивационных составляющих эмоциональных переживаний, связанных с болью.
Перед достижением чувствительных участков коры головного мозга, болевая импульсация проходит, так называемую, предварительную обработку в определенных отделах центральной нервной системы. Это уже упомянутый таламус (зрительный бугор), гипоталамус, сетчатая (ретикулярная) формация, участки среднего и продолговатого мозга. Первый, и, пожалуй, один из самых важных фильтров на пути болевой чувствительности – это таламус. Все ощущения из внешней среды, от рецепторов внутренних органов – всё проходит через таламус. Невообразимое количество чувствительной и болевой импульсации проходит ежесекундно, днем и ночью через данный участок мозга. Мы не ощущаем, как происходит трение клапанов сердца, движение органов брюшной полости, всевозможных суставных поверхностей друг о друга – и всё это благодаря таламусу.
При нарушении работы, так называемой, антиболевой системы (например, в случае отсутствия выработки внутренних, собственных морфиноподобных веществ, возникшей по причине употребления наркотических средств) вышеупомянутый шквал всевозможной болевой и прочей чувствительности просто захлестывает головной мозг, приводя к ужасающим по длительности, силе и выраженности эмоционально-болевым ощущениям. Такова причина, в несколько упрощенном виде, так называемой «ломки» при дефиците поступления извне морфиноподобных веществ на фоне длительного приема наркотических средств.
Как болевой импульс обрабатывается головным мозгом?
 Задние ядра таламуса дают информацию о локализации источника боли, а срединные его ядра – о продолжительности воздействия раздражающего агента. Гипоталамус, как важнейший регуляторный центр вегетативной нервной системы, участвует в образовании вегетативного компонента болевой реакции опосредованно, через задействование центров регулирующих обмен веществ, работу дыхательной, сердечно-сосудистой и других систем организма. Ретикулярная формация координирует уже частично обработанную информацию. Особенно подчеркивается роль ретикулярной формации в формировании ощущения боли как некоего особого интегрированного состояния организма, с включением всевозможных биохимических, вегетативных, соматических составляющих. Лимбическая система мозга обеспечивает негативную эмоциональную окраску.Сам процесс осознания боли как таковой, определение локализации болевого источника (имеется ввиду конкретная область собственного тела) в совокупности со сложнейшими и разнообразнейшими реакциями на болевую импульсацию происходит непременно при участии мозговой коры.
Задние ядра таламуса дают информацию о локализации источника боли, а срединные его ядра – о продолжительности воздействия раздражающего агента. Гипоталамус, как важнейший регуляторный центр вегетативной нервной системы, участвует в образовании вегетативного компонента болевой реакции опосредованно, через задействование центров регулирующих обмен веществ, работу дыхательной, сердечно-сосудистой и других систем организма. Ретикулярная формация координирует уже частично обработанную информацию. Особенно подчеркивается роль ретикулярной формации в формировании ощущения боли как некоего особого интегрированного состояния организма, с включением всевозможных биохимических, вегетативных, соматических составляющих. Лимбическая система мозга обеспечивает негативную эмоциональную окраску.Сам процесс осознания боли как таковой, определение локализации болевого источника (имеется ввиду конкретная область собственного тела) в совокупности со сложнейшими и разнообразнейшими реакциями на болевую импульсацию происходит непременно при участии мозговой коры.Сенсорные участки коры головного мозга являются высшими модуляторами болевой чувствительности и играют роль, так называемого, коркового анализатора информации о факте, длительности и локализации болевого импульса. Именно на уровне коры происходит интеграция информации от различных видов проводников болевой чувствительности, что означает полновесное оформление боли как многогранного и многообразного ощущения.В конце прошлого века было выявлено, что каждый уровень построения болевой системы от рецепторного аппарата до центральных анализирующих систем мозга может обладать свойством усиления болевой импульсации. Как бы своего рода трансформаторные подстанции на линиях электропередач.
Приходится говорить даже о, так называемых, генераторах патологически усиленного возбуждения. Так, с современных позиций данные генераторы рассматриваются как патофизиологические основы болевых синдромов. Упомянутая теория системных генераторных механизмов позволяет объяснить, почему при незначительном раздражении болевой ответ бывает довольно значителен по ощущениям, почему после прекращения действия раздражителя ощущение боли продолжает сохраняться, а также помогает объяснить появление боли в ответ на стимуляцию зон кожной проекции (рефлексогенных зон) при патологии различных внутренних органов.
Хронические боли любого происхождения приводят к повышенной раздражительности, снижению работоспособности, потере интереса к жизни, нарушению сна, изменениям эмоционально-волевой сферы, часто доводят до развития ипохондрии и депрессии. Все указанные последствия уже сами по себе усиливают патологическую болевую реакцию. Возникновение подобной ситуации трактуется как образование замкнутых порочных кругов: болевой раздражитель – психо-эмоциональные нарушения – поведенческие и мотивационное нарушения, проявляющиеся в виде социальной, семейной и личностной дезадаптации – боль.
Антиболевая система (антиноцицептивная) – роль в организме человека. Порог болевой чувствительности
 Наряду с существованием в организме человека болевой системы (ноцицептивной
), существует еще и антиболевая система (антиноцицептивная
). Что осуществляет антиболевая система? Прежде всего, для каждого организма существует свой, генетически запрограммированный порог восприятия болевой чувствительности. Данный порог позволяет объяснить, почему на раздражители одинаковой силы, продолжительности и характера разные люди реагируют по-разному. Понятие порога чувствительности – это универсальное свойство всех рецепторных систем организма, в том числе и болевых. Так же как и система болевой чувствительности, антиболевая система имеет сложное многоуровневое строение, начиная с уровня спинного мозга и заканчивая мозговой корой.
Наряду с существованием в организме человека болевой системы (ноцицептивной
), существует еще и антиболевая система (антиноцицептивная
). Что осуществляет антиболевая система? Прежде всего, для каждого организма существует свой, генетически запрограммированный порог восприятия болевой чувствительности. Данный порог позволяет объяснить, почему на раздражители одинаковой силы, продолжительности и характера разные люди реагируют по-разному. Понятие порога чувствительности – это универсальное свойство всех рецепторных систем организма, в том числе и болевых. Так же как и система болевой чувствительности, антиболевая система имеет сложное многоуровневое строение, начиная с уровня спинного мозга и заканчивая мозговой корой.Как регулируется деятельность антиболевой системы?
Сложная деятельность антиболевой системы обеспечивается цепочкой сложных нейрохимических и нейрофизиологических механизмов. Основная роль в этой системе принадлежит нескольким классам химических веществ – мозговым нейропептидам, В их число входят и морфиеподобные соединения – эндогенные опиаты (бета-эндорфин, динорфин, различные энкефалины). Названные вещества могут считаться так называемыми эндогенными анальгетиками. Указанные химические вещества обладают угнетающим воздействием на нейроны болевой системы, активируют антиболевые нейроны, модулируют активность высших нервных центров болевой чувствительности. Содержание данных антиболевых веществ в центральной нервной системе при развитии болевых синдромов уменьшается. По всей видимости, этим и объясняется снижение порога болевой чувствительности вплоть до появления самостоятельных болевых ощущений на фоне отсутствия болевого раздражителя.Следует также отметить, что в антиболевой системе наряду с морфиеподобными опиатными эндогенными анальгетиками большую роль играют и широко известные мозговые медиаторы, такие как: серотонин, норадреналин, дофамин, гамма-аминомасляная кислота (ГАМК), а также гормоны и гормоноподобные вещества – вазопрессин (антидиуретический гормон), нейротензин. Интересно, что действие мозговых медиаторов возможно как на уровне спинного, так и головного мозга. Резюмируя вышесказанное, можно заключить, что включение антиболевой системы позволяет ослабить поток болевой импульсации и снизить болевые ощущения. При возникновении каких-либо неточностей в работе данной системы любая боль может быть воспринята как интенсивная.
Таким образом, все болевые ощущения регулируются совместным взаимодействием ноцицептивной и антиноцицептивной систем. Только их согласованная работа и тонкое взаимодействие позволяет адекватно воспринимать боль и её интенсивность, в зависимости от силы и продолжительности воздействия раздражающего фактора.